医療機器の設計情報をPLMで効率的に管理


プロジェクト概要
背景
・設計情報管理を電子化して業務効率を向上する必要性
・日本や米国の厳格な規制に対応することが必須
ソリューション
・Matrixを採用することで、すべての履歴を保存
・監査に対応できるノウハウと実績
成果
・社内承認にかかる時間を5分の1に
・紙の書類が不要になった
医療機器書類の管理には厳しい規制が存在
パナソニック四国エレクトロニクスのヘルスケア事業グループは、超音波診断装置などの医療機器を開発・製造している。「設計図面を紙で、部品の品番やその親子関係などをメインフレームで管理していました」とIT推進グループ横浜地区IT推進チームチームリーダーは振り返る。
製品によっては、書類が事務ファイル50冊分にもなることもあった。さらに、国内では薬事法、米国ではFDA(食品医薬品局)関係の法律が変更履歴の厳格な管理を求める。設計変更の際は、多ければ12人の承認を受けるが、これも負担が大きかった。
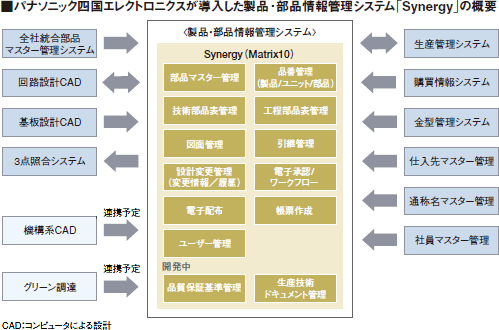
そこで、図面や部品表の管理・ワークフローのシステム化などの設計業務効率化の仕組み「PLM(製品ライフサイクル管理)」を導入することになった。履歴管理に優れるMatrixと実績を持つITベンダーを採用
米国へ輸出する医療機器は、「21 CFRPart11(連邦規則第21章第11条)」という基準を満たす必要がある。「機器の開発プロセスを電子化して管理し、データの完全性を保証することは、かつては事実上不可能と言われていました」(IT推進グループ横浜地区IT推進チーム主事/システムエンジニア)。
今回のシステム化では、書類が改竄されていないことを示すバリデーションと監査証跡が2つのポイントだった。FDAの規制では、システムの正当性に加えて、開発するベンダーが規制に適合するかまでも綿密に監査される。
同社はPLMプラットフォーム製品として「Matrix」に注目する。「Matrixでは基本機能で、すべての履歴を残せます。海外ではPart11対応の実績も出ていました」(IT推進グループ横浜地区IT推進チーム主事/システムエンジニア)。
開発ベンダーには、パナソニックグループでの開発実績も豊富な新日鉄ソリューションズを選んだ。新システムで社内承認の時間は5分の1に
開発は2004年7月スタート,2005年8月にサービス・インした。新日鉄ソリューションズは、開発ベンダーに対する第三者による監査も予定どおりクリアした。
新システムでは、利用者がWebブラウザで部品表や図面の管理や承認などを行える。紙のドキュメントは基本的に不要になり、保管スペースの増加も止まった。
社内承認にかかる時間は5分の1になった。従来は、設計変更時などの社内承認において、起案から工場へのデータ受け渡しまで平均5日かかったが、今は1日で終わるという。
コアテクノロジー
PLM、Matrix10/J2EE(MVCモデル)を用いたWebシステムの構築
システム概要
●サーバー
(Windows 2000 Server):DB兼ストアサーバー×2,APサーバー×1,バッチサーバー×2,バックアップサーバー×1
●クライアント
約300
●ミドルウエア
Oracle9i、Matrix10、JP1


パナソニック四国エレクトロニクス株式会社様
本社:愛媛県東温市南方2131番地1
創立:1969年
資本金:79億円(2007年4月現在)
売上高:1508億円
従業員数:約3000名(2007年4月現在)


